علم الوراثة.
من ويكيبيديا، الموسوعة الحرة

علم الوراثة أو الوِرَاثِيَّات Genetics) هو العلم الذي يدرس المورثات (الجينات) والوراثة وما ينتج عنه من تنوع الكائنات الحية. وكانت مبادئ توريث الصفات مستخدمة منذ تاريخ بعيد لتحسين المحصول الزراعي وتحسين النسل الحيواني عن طريق تزويج حيوانات من سلالة ذات صفات جيدة – كمثال عن ذلك الحصان العربي الأصيل حيث كان العرب يزاوجون الحصان والفرس الأقوياء ليحصلوا على نسل قوي واستمروا بذلك عبر السنين -.
ولكن علم الوراثة الحديث الذي حاول فهم آلية توريث الصفات ابتدأ بالعالم غريفور مندل Gregor Mendel في منتصف القرن التاسع عشر، حيث قام مندل بمراقبة الصفات الموروثة للكائنات الحية وكيفية انتقالها من الآباء إلى الأبناء، ولكنه لم يكتشف آلية هذا الانتقال التي تتم عن طريق وحدات مميزة في توريث الصفات وهي المورثات (الجينات) Genes، وهي تمثل مناطق معينة من شريط الـDNA، هذا الشريط هو عبارة عن تتالي وحدات جزيئية تدعي النيكليوتيدات Nucleotides، ترتيب وتسلسل هذه النيكليوتيدات يمثل المعلومات الوراثية لصفات الكائن الحي.
لاحظ مندل أن الكائنات الحية ترث الصفات بطريقة مميزة (قابلة للعد) "وحدات الوراثة ". هذا المصطلح والذي لا يزال مستخدما حتى وقتنا الحاضر يُعد تعريفا مبهما نوعا ما للجينات (المورثات). التعريف العملي الأكثر حداثة للجينات هي أنها الجزء (أو التسلسل) من الحمض النووي الذي يرمز لوظيفة خلوية معينة معروفة. هذا الجزء من الحمض النووي هو متغير أي انه يمكن ان يكون صغيرا أو كبيراً، وقد يحتوي على القليل او الكثير من الأقسام الفرعية. كلمة (مورث) "جين" تشير إلى الاجزاء من الحامض النووي المطلوبة من أجل عملية خلوية واحدة أو وظيفة واحدة، أكثر من كونها تشير إلى عنصر مادي واحد. المصطلح الذي يستخدم غالبا (ولكن ليس دائما صحيحا) هو "جين واحد، بروتين واحد" ويعني أن كل جين معين يرمز إلى نوع معين من البروتين في الخلية. تشبيه اخر هو أن الجينات هي مثل "الجمل" والنيوكليوتيدات مثل "الأحرف". يمكن وضع سلسلة من النيوكليوتيدات معا دون ان تشكل جينا (المنطقة الغير رمزية في الحمض النووي)، تماما كوضع مجموعة من الأحرف بشكل عشوائي دون أن تشكل جملة مفيدة ، ومع ذلك فجميع الجمل يجب ان تحتوي على حروف، كما يجب أن تحتوي جميع الجينات على نيوكليوتيدات.
يتواجد الـDNA بشكل طبيعي على هيئة سلسلة مزدوجة، كل نيكلوتيد من السلسلة الأولى يقابله ويتممه نيكليوتيد من السلسلة الثانية. فكل سلسلة مفردة تقوم بعمل قالب للسلسلة الأخرى، وهذه هي آلية انتساخ الـDNA واتنقال المورثات.
تترجم الخلية ترتيب النيكليوتيدات في المورثة إلى سلسلة من الأحماض الأمينية amino acids وهذه السلسلة تؤلف بروتين معين- ترتيب الأحماض الأمينية في البروتين تتوافق مع ترتيب النيكليوتيدات في المورثة، والعلاقة بين ترتيب النيكلوتيدات وترتيب الأحماض الأمينية تدعى الشيفرة الوراثية genetic code.
الأحماض الأمينة التي تؤلف البروتين تحدد شكله الثلاثي الذي يحدد وظيفة البروتين ودوره، فتختلف بذلك البروتينات عن بعضها البعض لتلعب أدواراً مختلفة في الخلية، فالبروتينات تلعب تقريباً كافة الوظائف داخل الخلية.
فتغير واحد في الـDNA لجينة(مورثة) معينة يؤدي إلى تغير في الأحماض الأمينية لأحد البروتينات مما يغير شكله فتتغير وظيفته ودوره وقد يكون هذا التغير ممرض أو مميت للخلية وللكائن الحي بشكل عام- مثال مرض فقر الدم المنجلي Sickle Cell Anemia ناتج عن تغير لنيكلوتيد واحد مما يغير أحد الأحماض الأمينية مما يغير البروتين فيتغير دوره فتتشكل كرات دم غير قادرة على نقل الأوكسجين بشكل طبيعي فيتنج عنه مرض فقر الدم المنجلي-. وعلى الرغم من أن الوراثة تلعب دوراً في شكل وتصرفات الكائن الحي، لكن ما يمر به الكائن الحي من تجارب في حياته يلعب دورا كبيراً في ذلك- مثال الجينات مسؤولة عن تحديد طول الشخص ولكن التغذية والظروف التي مر بها هذا الشخص في طفولته تؤثر وتلعب دوراً كبيراً أيضاً.
بدأ علم الوراثة على يد العالم المشهور مندل بدراسة انتقال الصفات الوراثية من الآباء للأبناء ونسب توزعها بين افراد الأجيال المختلفة. تعرف هذه الدراسات الآن بعلم الوراثة الكلاسيكي. لكن التقنيات الحديثة سمحت لعلماء الوراثة حاليا باستقصاء آلية عمل الجينات ومعرفة التسلسل الدقيق للحموض الأمينية ضمن دنا ورنا المادة الوراثية ليقوموا بعد ذلك بربط هذا التسلسل بالمورثات، وقد سمح هذا بإتمام واحد من أضخم مشاريع القرن العشرين : وهو مشروع الجينوم البشري.
المعلومات الوراثية بشكل عام تكون محمولة ضمن الصبغيات الموجودة في نواة الخلايا وتحوي ضمنها الدنا الحامل الأساسي للمورثات.
تقوم الجينات بتشفير المعلومات الضرورية لاصطناع سلاسل الأحماض الأمينية التي ستدخل في تركيب البروتينات المختلفة، هذه البروتينات ستلعب بدورها دورا كبيرا في تحديد النمط الظاهريالنهائي للمتعضية. عادة في الأحياء ثنائية الصيغة أحد النسخ الجينية (الحليل) المسيطرة سوف تطغى بصفاتها على صفات الجينة المتقهقرة (الضعيفة).
انتشر في الوراثيات الكلاسيكية مبدأ يقول (لكل مورثة واحدة، بروتين واحد) بمعنى ان كل مورثة تحمل معلومات لبناء بروتين وأحد فقط، لكن هذه العبارة يشكك بها كثيرا هذه الأيام وتعتبر إحدى الأخطاء التبسيطية التي وقع بها علم الوراثة الكلاسيكي.
من المؤكد الآن أنه يمكن لنفس المورثة أن تنتج عدة بروتينات ويتحكم بهذا الأمر طريقة ترجمة (تحويل) الشفرة الوراثية وتنظيم هذه العملية المعقدة.
تقوم المورثات بتحديد مظهر الكاثنات الحية الخارجي إلى حد كبير، وهناك احتمال يطرحه البعض فكلتحكمها بالسلوك البشري لكن هذه القضية ما زالت قيد نقاش عميق وتختلف وجهة النظر حسب التوجهات العلمية للباحثين.
الأطباء المتدربين أيضا على علم الوراثة يقومون بتشخيص الأمراض الوراثية عند المرضى بكفاءة. يتم تدريس ذلك للأطباء في مناهج إقامة أو اختصاص.
تاريخ علم الوراثة
على الرغم من أن علم الوراثة بدأ مع الأعمال التطبيقية والنظرية جريجور مندل في منتصف القرن 19 إلا أن نظريات أخرى للوراثة سبقت مندل. وكانت النظرة الشعبية خلال وقت مندل مفهوم الوراثة المتمازجة: وهي فكرة أن الأفراد يرثون مزيجاً سلساً من الصفات عن والديهم. أعمال مندل أعطت أمثلة لصفات لا تتمازج بشكل مؤكد بعد التهجين، وتبين أن تلك الصفات يتم إنتاجها من قبل مجموعات من جينات مميزة بدلا من مزيج مستمر. وتفسر الآن الصفات المتمازجة في ذرية ما بعمل جينات متعددة بأسلوب كُمِّي. وهناك نظرية أخرى لديها بعض الدعم في ذلك الزمان وهي الوراثة للخصائص المكتسبة: الاعتقاد بأن الأفراد يرثون صفات تعزز من قبل آبائهم. ومن المعروف الآن أن هذه النظرية (المرتبطة عادة مع جان باتيست لامارك) قد أثبتت خطئها، وأن ممارسات الأفراد لا تؤثر على الجينات التي تنتقل إلى أطفالهم.
بالرغم من أن هناك أدلة في مجال علم التخلق تؤجج بعض جوانب نظرية َلمارك .كانت من بين النظريات الأخرى نظرية شمولية التخلق لــ تشارلز داروين ( التي شملت جوانب التوريث و الاكتساب) و شمولية التخلق لكل من الجسيمات و الموروثات التي كان قد أعاد صياغتها فرانسيس غالتون
المندلية و علم الوراثة الكلاسيكية
بدأ علم الوراثة الحديث مع غريغور يوهان مندل، و هو راهب أوغاستيني تشيكي-ألماني و عالم درس طبيعة الوراثة في النباتات. في دراسته بعنوان "تجارب حول تهجين النباتات" التي قدمها إلى جمعية أبحاث الطبيعة في برون في سنة 1865م؛تتبع مندل الأنماط الوراثية في صفات نبات البازلاء و وصفها رياضيًا و بالرغم من أنه لا يمكن ملاحظة هذه الأنماط الوراثية إلا لدى فصائل قليلة، إلا أن تجارب مندل اقترحت بأن الوراثة جزيئية، و هي غير مكتسبة، و أنه من الممكن تفسير السمات الوراثية في العديدمن الأنماط من خلال بعض الأسس البسيطة و النسب. لم يحظ عمل مندل بأهمية واسعة النطاق حتى تسعينات القرن التاسع عشر، و ذلك بعد وفاته عندما بحث علماء آخرون في مسائل مشابهة مما أدى إلى إعادة اكتشاف أبحاثه. ويليام باتسون، أحد مؤيدي أعمال مندل، كان من صاغ مصطلح علمالوراثة في سنة 1905م . ( و هي كلمة مُشتقة من أصل يوناني و تعني "البداية" و قد تم استخدامها أول مرة في علم الأحياء في سنة 1860م) روَّج باتسون مصطلح علم الوراثة في خطابه الافتتاحي للمؤتمر الدولي الثالث في تهجين النباتات بلندن سنة ١٩٠٦م . بعد إعادة اكتشاف أعمال مندل، حاول العلماء تحديد الجزيئات المسؤولة في الخلية عن الوراثة. في سنة 1911م، ناقش توماس هَنت مورغن مسألة وجود الجينات على الكروموسومات، بناءً على ملاحظاته لطفرات العين البيضاء ذات العلاقة بالجنس فيذبابة الفواكه (sex linked white eye mutation in fruit flies). و في سنة1913م، استخدم تلميذه آلفرد سترتيفانت ظاهرة الترابط الجيني لإظهار أن الجينات مصفوفةبشكل خطي على الكروموسومات

Morgan's observation of sex-linked inheritance of a mutation causing white eyes in Drosophila led him to the hypothesis that genes are located upon chromosomes.

ملاحظة مورغان لوراثة المرتبطة بالجنس من طفرة تسبب بياض العينين
في ذبابة الفاكهة، مما أدى به إلى فرضية أن الجينات تقع على الكروموسومات.
علم الوراثة الجزيئي
تم تأسيس علم الوراثة الجينية الحقيقية والتي تؤدي إلى الوراثة الجزيئي بناء على علم الوراثة الكلاسيكي لكنه يرتكز أكثر على بنية و وظيفة المورثات على المستوى الجزيئي. مع أن تواجد الجينات على الكروموسومات كان أمراً معروفاً إلا أن الكروموسومات تتكون من البروتينات و الأحماض النووية DNA معاً ; لذا لم يعلم العلماء أياً منهما المسؤول عن الوراثة . و قد اكتشف فريدريك غريفيث في عام 1928 م ظاهرة التحويل ( انظر " تجربة غريفيث " ) : أي إمكانية نقل البكتيريا الميتة للمادة الوراثية حتى تتحول إلى بكتيريا أخرى لا تزال حية . و بعد ستة عشر عاماً - في 1944 م - حدد أوسوالد ثيودور أفري و كولن ماكلويد و ماكلن مكارتي الجزيئية المسؤولة عن التحويل بأنها الحمض النووي DNA. و كان قد تم التأكد من دور نواة الخلية كمستودع للمعلومات الوراثية في الكائنات الحية حقيقية النوى من قبل هامرلنغ في سنة 1943 م من خلال عمله على الطحلب وحيد الخلية " االحقّاء " ( جنس من الطحالب الخضراء ) . كما أكدت تجربة هيرشي – تشيز التي أُجريت في عام 1952 م أن DNA الحمض النووي - و ليس البروتين - هو المادة الوراثية للفيروسات التي تصيب البكتيريا ، مما قدم المزيد من الأدلة التي تُثبت أن الحمض النووي هو الجزيئية المسؤولة عن الوراثة
حدد الدكتوران جيمس واطسون وفرانسيس كريك بنية الحمض النووي في عام 1953، باستخدام الأشعة السينية لعلم البلورات من عمل روزا ليندا فرانكلين وموريس ويلكنز والتي أشارت إلى أن الحمض النووي له بنية حلزونية (على شكل لولبي) وكان لنموذجهما الحلزوني المزدوج اثنان من خيوط الحمض النووي مع النيوكليوتيدات مشيرة إلى الداخل، كل من النيوكليواتيدات التكميلية له مطابق على خيط آخر لتشكيل ما يشبه الدرجات على سلم مفتول أظهرت هذه البنية المعلومات الوراثية الموجودة في تسلسل النيوكليويتدات في كل شريط من الحمض النووي. اقترحت البنية اأضا أسلوبا بسيطا بالنسبة للتضاعف الصبغي : إذا ما تم فصل الأشرطة يمكن إعادة بنائها من جديد وفق تسلسل الأشرطة القديمة . مع أن بُنية الDNA (الحمض النووي الريبوزي منقوص الأوكسجين) أظهرت كيفية عمل الوراثة، إلا أنه لم يكن معروفاً وقتها كيف يؤثر الDNA على سلوك الخلية. وفي السنين اللاحقة ، حاول العلماء أن يفهموا كيفية تحكم الDNA بعملية تصنيع البروتين. فتم اكتشاف أن الخلية تستعمل الDNA كقالب لتصنع منه مرسال الحمض الريبي النووي، وهو جزيئية ذو نوويد (نوكليوتيد) يشابه جداً الDNA. يُستعمل تسلسل النوكليوتيد لمرسال الحمض الريبي النووي لصُنع تسلسل من الأحماض الأمينية في البروتين؛ يعرف هذه التنقل بين تسلسل النوكليوتيد و تسلسل الحمض الأميني بالشفرة الجينية
أدى الفهم الجزيئي الحديث للوراثة إلى بداية ثورة من الأبحاث وإحدى أهم هذه التطورات كان تسلسل إنهاء سلسلة الحمض النووي في عام 1977 من قبل فردريك سانغر. حيث تسمح هذه التكنولوجيا للعلماء بأن يقرأوا تسلسل النوويد (النوكليوتيد) في جزيئية الدي ان اي (الحمض النووي الريبوزي منقوص الأكسجين) وفي عام 1983 طور كاري بانكس موليس تفاعل البوليميريز المتسلسل، مما أعطى طريقة جديدة لعزل وتضخيم جزء معين من الدي ان اي من أي خليط وذلك من خلال الجهود المُجتمعة لمشروع الجينوم البشري، ممثلة في وزارة الطاقة، ومعاهد الصحة الوطنية الأمريكية والجهود الخاصة الموازية من قبل سيليرا جينومكس بالإضافة إلى غيرها من وسائل في تسلسل الجينوم البشري في 2003
يضم علم الأحياء الخلوي والجزيئي العديد من فروع علم الأحياء التي ترتبط بدراسة العمليات الحيوية على مستوى الخلية وعلى المستوى الجزيئي ضمن الخلية وخارجها. يضم التقانة الحيوية، علم الوراثة، علم الأحياء التنموي وأخيرا علم الأحياء الدقيقة. علم الأحياء الخلوي يدرس الخلايا الحية من حيث فيزيولوجيتها وبنيتها وبنية عضياتها إضافة لدورة حياتها، الانقسام الخلوي وأيضا موت الخلية. أما علم الأحياء الجزيئي فيدرس العمليات الحيوية على المستوى الجزيئي مما يجعله متداخلا مع الكيمياء الحيوية وعلم الوراثة.
علم وراثة السكان
علم وراثة السكان يدرس القوى التي تؤثر على التنوع الجيني للسكان ونشوء الأنواع (تحور، تدفق، انتخاب) بتطوير نماذج رياضية وإحصاءاتية. كما وعلم وراثة السكان فهو دراسة توزيع تواتر الصبغيات والتغيير تحت تأثير عمليات اربع عمليات تطورية رئيسية هي : الانتقاء الطبيعي، الانحراف الجيني، الطفرة، وتدفق الجينات. كما فإنه يأخذ في عين الاعتبار أيضا عوامل التقسيم كإعادة التركيب السكاني والهيكل السكاني.
الجينوم
هو كامل المعلومات الوراثية المشفرة ضمن الدنا (و أحيانا ضمن الرنا كما في حال الفيروسات).
خاصيات الوراثة
الوراثة المنفصلة و قوانين مندل
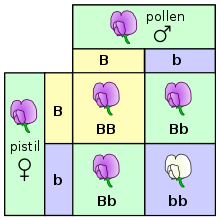
يصور مربع بونيت خليط بين اثنين من نبات البازلاء
متخالف للأزهار الأرجوانية (B) وللبيضاء (b)
في أبسط مستوياتها الأساسية، تحدث الوراثة في الكائنات الحية عن طريق سمات منفصلة تسمى الجينات. كان غريغور مندل هو أول من لاحظ هذه الخاصية من خلال دراساته لفصل السمات الموروثة في نبات البازلاء لاحظ مندل في تجاربه التي كانت لدراسة سمة لون الوردة أن لون كل وردة في كل نبتة بازلاء كان أبيضا أو بنفسجيا – لكن لم يكن أبدا لونًا متوسطًا بين هذين اللونين. تسمى هذه النسخ المختلفة المنفصلة للجين الواحد الألائل. في نبات البازلاء، و هي صنف دبلوئيد (ثنائي الصيغة الصبغية)، تمتلك كُل نبتة منفردة نسختين من كُل جين (مورثة)، تأتي من كلا الوالدين تمتلك العديد من الأصناف، منها البشر، هذا النمط من الوراثة. تُسمى الكائنات الحية التي تمتلك نسختين من نفس الأليل لجين (مورثة) واحد بمتماثلة الزيجوت في الموضع الصبغوي، بينما تُسمى الكائنات التي تمتلك أليلين مختلفين من نفس الجين بمغاير الزيجوت. تسمى مجموعة الألائل لأي كأن حي بالنمط الجيني، بينما تُسمى السمات التي يمكن ملاحظتها بالنمط الظاهري. عندما يكون الكائن مغاير الزيجوت في جين (مورث) معين، تُسمى إحدى الألائل صفة سائدة لأن خصائصها تسيد على النمط الظاهري للكائن، بينما يُسمى الأليل الآخر صفة متنحية لأن خصائصها تتنحى و لا يُمكن رؤيتها. بعض الألائل لا تمتلك صفة سائدة كاملة و تمتلك بدلاً من ذلك صفة سائدة غير تامة عن طريق تمثيلها بالنمط الظاهري المتوسط ، أو بتمثيلها للصفة السائدة المشتركة عن طريق تمثيلها بأليلين اثنين في آن واحد. عندما يتكاثر زوج من الكائنات الحية جنسياً، يرث نسلهما أليل واحد من كل والد بطريقة عشوائية . تُسمى هذه الاستدلالات عن الوراثة المنفصلة وانفصال الألائل عن بعضهما بقانون مندل الأول أو قانون الفصل .
التدوين والرسوم البيانية

الخرائط الوراثية النسبية تساعد في تتبع أنماط توريث الصفات.
يستخدم علماء الوراثة الرسوم البيانية والرموز لوصف الوراثة ، يُمثَل الجين بحرف أو عدد من الأحرف القليلة ، عادة يُستخدم الرمز " + " ليرمز إلى الأليلي غير المتحول المعتاد للجين
في تجارب التربية والإخصاب ( وخصوصاً عند مناقشة قوانين مندل ) يُشار إلى الوالدين بجيل " P " والنسل ( الفرع الأول ) بجيل " F1 " وعندما يتزاوج الفرع الاول " F1 " مع بعضهم البعض ، يُسمى الجيل الناتج ( الفرع الثاني ) بجيل " F2 " ، أحد الرسومات المعروفة المستخدمة للتنبّؤ بنتائج التهجين هو مربع بونيت. عند دراسة أمراض الإنسان الوراثية يستخدم علماء الوراثة عادةً الرسوم البيانية للأنساب ليشرحوا وراثة الصفات هذه الرسوم البيانية توضّح خريطة الوراثة لصفةٍ ما في شجرة العائلة.
تفاعلات الجينات المتعددة
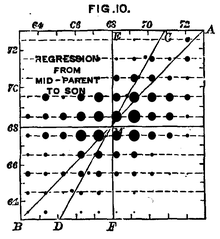
طول الإنسان هو سمة مع أسباب وراثية معقدة، وتبين بيانات فرانسيس غالتون من عام 1889م العلاقة بين طول النسل بوصفها وظيفة من متوسط طول الأم، بينما تبقى الاختلافات في ارتفاع ذرية المشيرة إلى البيئة هي أيضاً عامل مهم في هذه الصفة.
تمتلك الكائنات الحية آلاف الجينات ، التي تنقسم بشكل مستقل عن بعضها بعضاً أثناء عملية التكاثر الجنسي للكائنات الحية ، هذا يعني بأن وراثة الأليل لبازلاء خضراء أو صفراء اللون لا علاقة لها بوراثة الأليلات للورود الحمراء أو البيضاء ، وتُعرف هذه الظاهرة باسم " قانون مندل الثاني " أو " قانون الانقسام المستقل " ، بمعنى أن هذه الأليلات من الجينات المختلفة تُعدّل وراثياً بين الآباء لتُشكّل نسل جديد بتركيبات كثيرة مختلفة ، ( لا تنقسم بعض الجينات بشكل مستقل ، ممايدل على الارتباط الجيني ) تتم مناقشة هذا الموضوع لاحقا في هذه المقالة
تتفاعل عادةً الجينات ( المورثات ) بطرق مختلفة تؤدي إلى التأثير على نفس السمة ، على سبيل المثال : جين نبات أومفالوديس فيرنا الذي يمتلك الأئل التي تتحكم بلون الزهور ( أزرق أو أحمر أرجواني ) لكن هناك جين آخر يتحكّم في وجود اللون على الزهور في الأساس أو يُعطي زهوراً بيضاء اللون ، عندما تمتلك النبتة نسختين من هذا الأليل الأبيض ، تكون الزهور بيضاء ، بغضّ النظر عن امتلاك الجين الأول ألألائل زرقاء أو أحمر أرجواني ، يُسمى هذا التفاعل بين الجينات بتَوَقُّفُ الإِفْراز، حيث يوقِف الجين الثاني إفراز الجين الأول.
لا تُعد العديد من الصفات الوراثية ذات سمات منفصلة ( مثل : الزهور البيضاء أو الأرجوانية ) بل تمتلك سمات متواصلة ( مثل : طول الإنسان ولون البشرة ) ، تُعد هذه الصفات المعقدة نتاج العديد من الجينات. يتوسط تأثير هذه الجينات بدرجات متفاوتة من خلال البيئة التي عاشها الكائن الحي ، تسمى الدرجة التي تساهم فيها جينات الكائن الحي بإحداث صفة معقدة بـالتوريث. يُعد قياس التوريث لصفة واحدة أمر نسبي في بيئة أكثر تقلبية ، تملك البيئة المحيطة التأثير الأكبر على الاختلاف الكلي لهذه الصفة. على سبيل المثال ، يُعد طول الإنسان صفة بمسببات معقدة. تحتوي هذه الصفة نسبة ٨٩٪ من التوريث في الولايات المتحدة ، بينما في نيجيريا ، حيث يعاني الناس من صعوبة أكثر للوصول إلى التغذية الجيدة والرعاية الصحية ، تمتلك صفة الطول نسبة ٦٢٪ فقط من التوريث.
الأساس الجزيئي للوراثة
الأحماض النووية و الكروموسومات (الصبغيات)

التركيب الجزيئي للحمض النووي، وقواعد الزوج
لترتيب الرابطة الهيدروجينية بين الفروع.
الاساس الجزيئي للجينات هو (الحمض النووي الرايبوزي منقوص الأكسجين) او DNA. يتكون الحمض النووي من سلسلة من النيوكليوتيدات, وهي عبارة عن اربعة انواع: أدينين (A), سايتوسين (C), غوانين (G), ثايمين (T). تتواجد المعلومات الوراثية في تسلسل (ترتيب) هذه النيوكليوتيدات, وتتواجد الجينات على شكل سلاسل (تعاقبات) ممتدة على طول سلسة الحمض النووي. الفيروسات هي الاستثناء الوحيد من هذه القاعدة- فأحيانا تستخدم الفيروسات الحمض الريبي النووي RNA المماثل جدا للحمض الرايبوزي النووي DNA عوضا عنه, وذلك كمادة وراثية ومما تجدر الاشارة إليه أنه لا يمكن للفيروسات التكاثر بدون وجود المضيف (العائل) ولا تُعد عامة مخلوقات "حية", لذلك لا تخضع للكثير من مبادئ علم الوراثة.
يوجد الحمض النووي بشكل طبيعي كجزء مزدوج الأشرطة الملفوفة على شكل حلزوني مزدوج، كل نوكليوتيد في الحمض النووي يقترن بشكل تفضيلي مع شريكة النوكليوتيد آخر على الشريط المعاكس A المقترن مع T ويقترن كذلك مع C و G. و بهذا الشكل المكون من شريطين الذي يحوي كل شريط منه على جميع المعلومات الضرورية، وهذا أيضًا ما يحصل مع شريطه الشريك. تعتبر هذه البنية للحمض النووي الأساس الطبيعي للتوريث فيُكرر نسخ الحمض النووي المعلومات الوراثية عن طريق تقسيم شريط الحمض النووي و استخدام كل شريط كقالب لإنشاء شريط حمض نووي شريك جديد
يتم ترتيب الجينات خطيا على شكل سلاسل طويلة من تسلسل القواعد النيتروجينية في الحمض النووي.يكون منفرد , عادة ما تحتوي كل خلية على حامل جين دائري ( genophore) , بينما في الكائنات حقيقية النواة ( كالإنسان والحيوان) تملك الحمض النووي المرتب في كروموسومات خطية متعددة. وغالباً ما تكون شرائط الحمض النووي طويلة جدا، على سبيل المثال: يبلغ طول أطول كروموسوم في الإنسان 247 مليون زوج من القواعد النيتروجينية تقريباً يرتبط الحمض النووي لكروموسوم ببروتينات هيكلية التي تقوم بالتنظيم، الجمع و التحكم بالدخول الحمض النووي،مكون من مادة تسمى بالكروماتين (chromatin):في الكائنات حقيقية النواة الكروماتين يكون مكون من نيوكليوزوم ( nucleosomes) ,أجزاء من الحمض النووي تشق الطريق نحو بروتين الهستون يطلق على المجموعة الكاملة من المواد الوراثية في الكائنات الحية (عادة ما تُسمى مجموعة سلسلة الحمض النووي لجميع الكروموسومات) بالجينوم (genome).
بينما توجد كائنات تحتوي على نسخة واحدة من كل كروموسوم أما معظم الحيوانات وأنواع عديدة من النباتات تمتلك أعداد مضاعفة من النسخ وتحتوي على اثنين من كل كروموسوم ونسختين من الجينات الثنائية في الأليليات يكون متموضعا بشكل هندسي في الكروموسومات المتماثلة .كل واحد من الأليليا يأتي وراثياً من أحد الوالدين .

رسم فالتر فليمنغ في عام 1882م
لانقسام الخلايا حقيقة انلواة،
يتم نسخ الكروموسومات ومضاعفتها
وتنظيمها
ثم كما تنقسم الخلة فالكروموسومات
تنسخ منفصلات في الخلايا الوليدة.
الكثير من الشكوك تبقي حول ما يسمى بالكروموسومات الجنسية .ومهمة هذه الكروموسومات نوعية جداً وهي تحديد جنس الجنين . في البشر والعديد من الحيوانات الكرموسوم واي يحتوي الجين الذكري والمحدد لخصائصه. يفقد هذا الكروموسوم في التطور معظم خصائصه بينما الكرموسوم اكس الشبيه ببقية الكرموسومات فيحتوي على غالب الجينات. الكروموسومان اكس و واي غير متجانسان من حيث تشكيلهما.
التكاثر
التكاثر اللا جنسي و التكاثر الجنسي عندما تنقسم الخلايا، يتم نسخ المجين (الجينوم) كاملاً و ترث كل خلية وليدة نسخة واحدة. تُعد هذه العملية المسماة بالانقسام الفتيلي أبسط أنواع التكاثر و هو أساس التكاثر اللا جنسي. يمكن أن يحدث التكاثر اللا جنسي في الكائنات متعددة الخلايا أيضاً، حيث يعطي ذرية ترث الجينوم من أحد الوالدين فقط. تُسمى الذرية المطابقة جينياً للوالدين بالنسخ. تستعمل حقيقيات النوى التكاثر الجنسي عادة لتوليد ذرية تحتوى على مزيج من المادة الوراثية موروث من والدين مختلفين. تتناوب عملية التكاثر الجنسي بين أصناف تحتوي على نسخ وحيدة من الجينوم (أحادي الصبغيات) و نسخ مزدوجة (ضعفاني الصبغيات). تندمج الخلايا أحادية الصبغة و تجمع المادة الوراثية لتكون خلية ضعفانية ذات صبغيات (كروموسومات) مزدوجة. تُكون الكائنات الضعفانية أحاديات الصبغة عن طريق الانقسام من دون استنساخ الحمض النووي الريبي منقوص الأكسجين (DNA) لتعطي خلايا وليدة ترث عشوائياً واحداً من كل زوج من الصبغيات. تكون معظم الحيوانات و العديد من النباتات ضعفانية الصبغيات خلال الجزء الأكبر من عمرها، و يكون الصنف أحادي الصبغيات محدوداً في الأمشاج مثل الحيوانات المنوية و البويضات.
بالرغم من عدم استخدامهم للطريقة الفردية\المضاعفة في التكاثر الجنسي، إلا أن للبكتيريا طرق عديدة لاكتساب المعلومات الجينية الجديدة. يمكن لبعض أنواع البكتيريا التزاوج، بنقل قطعة دائرية صغيرة من الحمض النووي لبكتيريا أُخرى. كما يمكن للبكتيريا احتلال شظايا الحمض النووي الجديدة الموجودة في المحيط ودمجها مع جينوماتها، وتسمى هذه الظاهرة بالتحول. تتم هذه العمليات على شكل نقل جيني أفقي، عن طريق إحالة شظايا المعلومات الجينية بين الكائنات الحية التي ستصبح بطريقة اخرى لاعلاقة لها.
إعادة التركيب والترابط الجيني
الارتباط الجيني

توضيح توماس هانت مورغان عام 1916م
لتقاطع مزدوج بين الكروموسومات.
تسمح طبيعة تضاعف الكروموسومات للجينات بتصنيف الكروموسومات المختلفة بشكل منفصل أو تنفصل عن التماثل الزوجي أثناء عملية التكاثر الجنسي حيث يتكون المشيج الفردي. يمكن بهذه الطريقة حدوث تركيبات جديدة للجينات خلال تناسل زوجين. ولن تتحد الجينات في الكروموسوم نفسه نظريا مرة اخرى. بل تحدث على أي حال من خلال العملية الخلوية لانتقال الكروموسومات. تتبادل الكروموسومات خلال الانتقال تمددالحمض النووي وتخلط الأليلات الجين بين الكروموسومات بشكل فعال تقع طريقة انتقال الكرموسومات هذه عموما خلال الانتصاف وخلال سلاسل من انقسامات الخلية التي تنشىء خلايا فردية.
يعتمد احتمال انتقال الكروموسومات التي تنشأ بين أي نقطتين في الكروموسوم الفردي على بُعد المسافة بين النقطتين، وتتسبب المسافات الطويلة جدًا بين الكروسومات في كبر احتمال انتقالها وتباعدها بما يكفي لإستبعاد إمكانية وراثة الجينات بشكل كبير أما بالنسبة للجينات القريبة من بعضها، فإن احتمال انتقالها وتباعدها ضئيلة للغاية مما يثبت الرابطة بين الأليلات للجينين، و يؤدي هذا بدوره إلى الميل نحو اعتقاد أن يكون الجين موروث. ويمكن جمع كميات الربط بين سلسلة الجينات لتكوين خريطة ربط خطية تصف ترتيب الجينات على طول الكروموسوم
التعبير الجيني
الشفرة الجينية

الشفرة الوراثية : استخدام رمز ثلاثي الدنا
من خلال وسيط الرنا المرسال المحدد للبروتين.
تُعبر الجينات عن تأثيرها الوظيفي خلال إنتاجها للبروتينات وهي جزيئات معقدة مسؤولة عن أغلب وظائف الخلية، تتكون البروتينات من سلسلة واحدة أو أكثر من عديد البيبتيدات وكل سلسلة مكونة من تسلسل الأحماض الأمينية أما تسلسل الحمض النووي للجين خلال الجين الوسيط للحمض النووي الريبي وينتج بذلك تسلسل معين للحمض الأميني . تبدأ العملية عند إنتاج الحمض النووي الريبي بتسلسل مطابق لتسلسل الحمض النووي في الجين وتدعى تلك العملية بالنسخ الجيني . ينتج جزيء الحمض النووي الريبي الوسيط تسلسل مماثل للحمض الأميني في عملية تدعى بالترجمة الجينية وكل مجموعة من الثلاث نيوكليوتيدات الموجودة في التسلسل تدعى بالرامزة وتتوافق إما مع الأحماض الامينية المحتملة في البروتين أو تقوم بإنهاء تسلسل الحمض الأميني ويدعى هذا التوافق بالشفرة الجينية ويكون تدفق المعلومات أحادي الإتجاه وتتنقل المعلومات من تسلسل النيوكليوتيدات لتسلسل الحمض الأميني في البروتينات ولكنها لاتتنقل من البروتين وتعود لتسلسل الحمض النووي، سمى فرنسيس كريك هذه الظاهرة بالعقيدة المركزية لعلم الأحياء الجزيئي
ينتج عن السلسلة النوعية للأحماض الأمينية هيكل ثلاثي الأبعاد فريد من نوعه لهذا البروتين وترتبط هياكل البروتينات ثلاثية الأبعاد بوظائفها، ويكون بعضها عبارة عن جزيئات هيكلية بسيطة مثل الألياف المكونة من بروتين الكولاجين ويمكن ربط البروتينات مع بروتينات أخرى وجزيئات بسيطة وهي تؤدي أحيانا دور الأنزيمات بتسهيل التفاعلات الكيميائة داخل حدود الجزيئات (دون تغيير هيكل البروتين نفسه). تعتبر بنية البروتين متحركة وينحني هيموغلوبين البروتين في أشكال مختلفة قليلا لكي تسهل عملية التقاط جزيئات الأكسجين و نقلها و إطلاقها داخل دم الثدييات
أحادي نوكليوتيد قد يُحدِث اختلاف في الحمض النووي تغيير في تسلسل الأحماض الأمينية للبروتين؛ حيث تبني سلسلة الأحماض الأمينية البروتين، قد تُحدث هذه التغييرات تغييرا هائلا في خصائص البروتين من خلال إضعاف تركيبه أو تغيير سطحه ؛ وذلك بتغيير تفاعله مع البروتينات والجزيئات الأخرى. على سبيل المثال ؛ فقر الدم المنجلي مرض وراثي ينتج من اختلاف قاعدة واحدة داخل منطقة الترميز لجزء متغير-غلوبين من الهيموغلوبين، مما يسبب تغيير حمض أميني واحد مما يغير الخواص الفيزيائية للهيموغلوبين.
بعض أنواع فقر الدم المنجلي تُبرز الهيموغلوبين، التجمع لتشكيل الألياف التي تشوه شكل خلايا الدم الحمراء التي تحمل البروتين. لا تتدفق تلك الخلايا منجلية الشكل بسلاسة في الأوعية الدموية، بل تميل لسدها أو التحلل، مما يتسبب في المعاناة ؛ من المشاكل الطبية المرتبطة بهذا المرض ؛ سجلت بعض الجينات في الحمض الريبي النووي ولكن لم يتم نقلها إلى منتجات مثل جزيئات الحمض الريبي النووي من البروتين ؛ وتسمى الحمض الريبي النووي غير المرمز. في بعض الحالات نتائج مضاعفة التراكيب التي تشارك في وظائفالخلية العصبية (مثل الحمض الريبي النووي الريبوسومي وتحويل الحمض الريبي النووي). الحمض الريبي النووي قد يكون له تأثير تنظيمي أيضا من خلال تفاعلات التهجين مع جزيئات حمض ريبي نووي أخرى.
الطبيعة مقابل التنشئة

القطط السيامية لديها طفرة تحسس
الحرارة منتجة الأصباغ
على الرغم من احتواء الجينات على جميع المعلومات اللازمة لوظائف الكائن الحي، إلا أن البيئة تلعب دوراً هاماً في تحديد الشكل النهائي لمظهر الكائن الحي، وغالباً ما يُشار إلى هذه الظاهرة بـ "الطبيعة مقابل الطبيعة". يعتمد الشكل الظاهري للكائن الحي على التفاعل بين الجينات و البيئة المحيطة به، مثل تلون "وبر" القط السيامي. في هذه الحالة درجة حرارة جسم القط تمثل دور البيئة. الشفرة الجينية للشعر الأسود في القط، بالتالي الخلايا المنتجة للشعر في القط تصنع البروتينات الخلوية التي تنتج في الشعر الداكن. لكن هذه البروتينات المنتجة للشعر الداكن حساسيتها عالية لدرجة الحرارة فتفسد في البيئة ذات الحرارة المرتفعة وبالتالي تفشل في أداء وظيفتها من حيث إنتاج صبغة الشعر الداكنة في المناطق التي تكون ذات درجة حرارة عالية في جسم القط. بينما في البيئة ذات درجة الحرارة المنخفضة, يبقى تركيب البروتين ثابت و يتم إنتاج صبغات الشعر الداكن بشكل طبيعي. يبقى البروتين فعال في المناطق الأبرد من البشرة (كالأقدام، الاذنين، الذيل و الوجه) لذلك يمتلك القط الوبر الغامق في اطرافه تلعب البيئة دوراً هاماً في آثار المرض الوراثي البشري ، فينيلكيتونوريا . حيث تؤدي الطفرة المسببة للمرض إلى حدوث خلل في مدى قابلية الجسم على تحليل الحمض الأميني فينيل الأمين، مما يتسبب في تراكم سام لجزيئية متوسطة والتي تتسبب بدورها في المعاناة من أعراض التخلف العقلي والصرع. مع ذلك، لو التزم الشخص الذي يملك طفرة فينيل الأمين باتباع نظام غذائي صارم يتجنب فيه تناول المواد التي تحتوي على هذا الحمض الأميني، فسيبقى طبيعياً و معافى. تُعد دراسة التوائم المتطابقة و الغير المتطابقة أو الأخوة في حالة تعدد المواليد طريقة مشهورة لتحديد كيفية مساهمة الجينات و البيئة في النمط الظاهري يكون الأخوان المتطابقان متماثلان وراثياً لانحدارهم من نفس اللاقحة، بينما يكون الإخوة الغير المتطابقين مختلفين وراثياً مثل الإخوة الطبيعيين. يستطيع العلماء تحديد ما إذا كان هذا الخلل ناتج عن عوامل وراثية أو بيئية من خلال تحليل الإحصائيات عن عدد المرات التي يمتلك فيها أحد التوائم من بين مجموعة من التوائم خللاً معيناً مقارنةً بمجموعات اخرى من التوائم . إحدى الأمثلة المشهورة هي دراسة تعدد المواليد للتوأم الرباعي غينان، الذين كانوا توأم رباعي متطابق شُخصوا جميعاً بمرض الفصام.
تنظيم الجينات
تحتوي المجموعات المورثة لكل كائن معين على الآلاف من الجينات، لكن لا تحتاج كل هذه الجينات إلى أن تكون نشطة في كل لحظة. يحدث التعبير الجيني عندما يتم تحويله إلى مراسل الحمض الريبي النووي و بذلك تتوفر طرق عديدة للتحكم في تعبيير الجينات بحيث يتم إنتاج البروتينات فقط عند الحاجة من خلال الخلية. تعتبر عوامل نسخ البروتينات التنظيمية و ترتبط بالحمض النووي، إما تشجع او تكبح عملية نسخ جين معين بداخل جينوم البكتيريا القولونية، على سبيل المثال توجد سلسلة من الجينات الهامة لتركيب أحماض التربتوفان الأمينية . وبالرغم من ذلك، عندما يتاح التربتوفان للخلية بشكل فعلي، لاتعود هناك فائدة لهذه الجينات المكونة للتربتوفان. يؤثر وجود التربتوفان بشكل مباشر على نشاط الجينات و ترتبط جزيئات التريبتوفان بكابح التريبتوفان (عامل النسخ)، وتغيير هيكل الكابح مثل ربط الكابح إلى الجينات. يمنع كابح التربتوفان عملية النسخ والتعبير الجيني، وبالتالي ينشأ نتائج سلبية من تنظيم عملية تركيب التربتوفان.
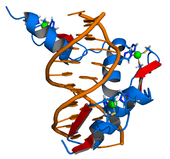
عوامل النسخ لربط الحمض النووري وتأثير نسخ الجينات المرتبطة بها.تظهر اختلافات التعبير الجيني بوضوح في الكائنات متعددة الخلايا، حيث أن جميع الخلايا تمتلك نفس الجين لكنها تمتلك بنيات و سلوكيات مختلفة بسبب التعبير عن مجموعات مختلفة من المورثات. تُشتق جميع الخلايا في الكائنات متعددة الخلايا من خلية واحدة تتمايز خلوياً إلى أنواع من خلايا مختلفة، مستجيبة لإشارات خارجية و داخلية، تؤسس تدريجياً أنماطاً مختلفة من التعابير الوراثية لتنتج سلوكيات مختلفة. بما أنه لا يوجد مورث معين مسؤول عن نمو البنيات في الكائن متعدد الخلايا، فإن هذه الأنماط تظهر من التفاعلات المعقدة بين العديد من الخلايا.
في حقيقيات النوى، هناك سمات بنيانية للكروماتين تؤثر على نسخ المورثات، عادة ما تكون على شكل تعديلات في الحمض النووي DNA(الحمض النووي الريبوزي منقوص الأكسجين) و الكروماتين اللذين ترثهما الخلايا الوليدة تُسمى هذه السمات بالوراثة اللاجينية لأنه توجد "فوق" تسلسل الحمض النووي DNA و تحافظ على الوراثة على امتداد الأجيال في الخلية. تستطيع أنواع خلايا مختلفة نمت في نفس المستنبت أن تُبقي على ميزات شديدة الإختلاف بسبب هذه السمات اللاجينية. مع أن السمات اللاجينية تكون غالباً متحركة على مدى النمو، إلا أن بعضها مثل ظاهرة الطفرة الموازية، تمتلك توارثاً يمتد على أجيال عديدة و تتواجد كاستثناءات نادرة عن القاعدة العامة و هي إن الحمض النووي DNA هوأساس الوراثة.
التغير الجيني
الطفرات
الطفرة الوراثية

الجينات الازدواجية تسمح بالتنويع من خلال التكرار:
فيمكن لجين واحد أن يتحور
ويفقد وظيفته الأصلية دور أي ضرر.
خلال عملية مضاعفة الحمض النووي DNA، تقع الأخطاء من حين لآخر اثناء التبلمر في الشريط الثاني. هذه الأخطاء تسمى الطفرات، من شأنها احداث تغيير في شكل الكائن الحي الخارجي، خصوصا إذا حدثت في سلسلة البروتين الذي يرمز للجين. تكون معدلات الخطأ قليلة جداً عادةً خطأ واحد لكل 10-100 مليون قاعدة، بسبب قدرة انزيم بوليميراز الدنا على التصحيح "proofreading" تسمى العمليات التي تزيد معدل حدوث التغيرات في الحمض النووي بالمُطفرة: وهي عبارة عن مواد كيميائية تزيد الأخطاء في عملية تضاعف الحمض النووي، غالباً عن طريق التعارض مع التركيب اثناء ارتباط القواعد، حيث تحفز الأشعة فوق البنفسجية الطفرات الوراثية عن طريق اتلاف تركيب الحمض النووي. كما يحدث الضرر الكيميائي للحمض النووي بشكل طبيعي، و تستخدم الخلية الآليات لإصلاح الخلل الحادث، عدم التطابق او الفواصل، في الحمض النووي، مع ذلك، تفشل هذه الآليات أحياناً في إعادة الحمض النووي إلى تسلسله الأول (او الطبيعي).
في الكائنات التي تقوم بخاصية العبور الكروموسومي لتبادل الحمض النووي وربط الجينات، قد تحدث الأخطاء في الصفوف خلال الانقسام الاختزالي لتسبب طفرات وراثية. من المرجح ان تحدث الأخطاء أثناء العبور الكروموسومي خاصة عندما يتسبب تسلسل مشابه بجعل الكروموسوم المقابل باعتماد الصف الخاطئ: مما يجعل بعض المناطق من الجين أكثر عرضة لحدوث الطفرة بهذه الطريقة. تتسبب هذه الأخطاء في حدوث تغييرات هيكلية كبيرة في تسلسل الحمض النووي، اما بمضاعفة، قلب أو حذف لكامل المنطقة، اوعن طريق استبدال جزء كامل من كروموسومات مختلفة بشكل عرضي يسمى ذلك بالإزفاء (اعادة الترتيب).
التطور
الانتقاء الطبيعي
تغير الطفرات التركيب الجيني للكائنات الحية ويسبب ذلك أحياناً في ظهور أنماط ظاهرية مختلفة. تؤثر معظم الطفرات على الكائنات الظاهرية قليلاً في أنماطها الظاهرية وصحتها ولياقتها الانجابية. أما الطفرات غير المؤثرة تكون عادةً ضارة ولكن قد يكون بعضها مفيدة أظهرت الدراسات على ذباب الفاكهة السوداء البطن أنه اذا أحدثت الطفرة تغييراً في البروتين الذي ينتجه الجين فستكون تلك الطفرة ضارة بنسبة ٧٠٪ والنسبة المتبقية تكون محايدة أو مفيدة بنسبة ضئيلة.

شجرة التطور للكائنات حقيقية النواة التي شيدت
بواسطة المقارنة بين متعدد متواليات الجينات.
تدرس الجينات السكانية اختلاف توزيع الجينات ضمن السكان وكيفية تغير هذه التوزيعات مع مرور الوقت حيث تتأثر التغيرات في التكرار الاليلي في السكان بشكل عام بالاصطفاء الطبيعي بحيث يعطي اليل ميزة انتقائية او انجابية للكائن الحي وكذلك كالعوامل الاخرى مثل الطفرة والانحراف الوراثي والترافق الجيني واصطفاء اصطناعي وانسياب المورثات
تستطيع جينومات الكائنات الحية على مدى عدة اجيال التغير بشكل ملحوظ مؤدياُ إلى ظاهرة التطور. يمكن أن يسبب اختيار التحول المفيد نوع من التطور الذي يؤدي إلى اشكال أفضل قادرة على العيش في محيطها تسمى هذه العملية بالتكيف. تتكون الانواع الجديدة من خلال عملية الانتواع والتي عادة ما تقع بسبب الفواصل الجغرافية التي تمنع السكان من تبادل الجينات مع بعضها ويعود التطبيق لمباديء الجينية لدراسة علم الاحياء السكنية والتطور لما مايسمى بالاصطناع التطوري الحديث.
بمقارنة التماثل والتشابه بين انواع جينومات مختلفة، من الممكن حساب مدى التطور بينها ومتى حدث الاختلاف( تسمى بالساعة الجزيئية). تعتبر المقارنات الجينية عموما طريقة اكثر دقة لتمييز العلاقة بين الانواع عن مقارنة الخصائص المظهرية. يمكن أن تستخدم مسافات التطور بين الانواع لتكوين شجرة التطور . هذه الاشجار تمثل السلف المشترك واختلاف الانواع على مدى الزمن، بالرغم من عدم اظهارها انتقال المادة الجينية بين الانواع غير المشتركة فيما بينها (تعرف بانتقال الجين العرضي والشائع في البكتيريا).
الأبحاث والتقنية
نموذج الكائنات الحية

ذبابة الفاكهة الشهيرة (ذبابة الفاكهة سوداء البطن)
هي كائن نموذجي شهير في أبحاث الوراثة.
على الرغم من أن علماء الوراثة يدرسون الوراثة عموماً على مجموعة كبيرة من الكائنات الحية؛ إلا أن الباحثين بدأوا التخصص في دراسة الوراثة على مجموعة فرعية معينة من الكائنات الحية. وفي واقع الأمر فإن البحوث الهامة الموجودة بالفعل لكائن معين تشجع الباحثين الجدد على اختيارها لعمل المزيد من الدراسة عليها، لذا فقد أصبح مؤخراً عدد قليل من نموذج الكائنات الحية هوالأساس لمعظم أبحاث الوراثة. الموضوعات البحثية العامة لنموذج الكائنات الحية في علم الوراثة تتضمن دراسة التنظيم الجيني ودور الجينات في النمو والسرطان. تم اختيار كائنات تتميز بقصر فترات أجيالها جزئياً، وذلك لسهولة التعديل الجيني مما جعلها شائعة كأداة من أدوات البحث في علم الوراثة. ويشتمل استخدام نماذج الكائنات الحية وعلى نطاق واسع على: بكتيريا الإشريكية القولونية في الأمعاء، نبات الأرابيدوبسيس، خميرة الخباز (فطريات الخميرة)، ديدان الربداء الرشيقة، ذبابة الفاكهة المعروفة باسم (ذبابة الفاكهة سوداء البطن)، وفأر المنزل المعروف باسم (فأر المنازل).
الطب
يسعى علم الوراثة الطبية لفهم كيفية الاختلاف الجيني ومدى تأثيره على صحة الإنسان والأمراض. عند البحث عن جين مجهول والذي قد يكون متضمن في مرض ما؛ عادةً ما يستخدم الباحثون الروابط الجينيةورسم الشجرة الوراثية للعثور على موقع الجينوم المرتبط بهذا المرض. وعلى مستوى السكان؛ يأخذ الباحثون عينة عشوائية للبحث عن مواقع الجينوم المرتبط بهذا المرض. وهذه الطريقة مخصصة للصفات متعددة الجينات غير المعروفة بشكل واضح من قبل جين واحد . ولحظة العثور على الجين المطلوب، من ناحية أخرى يتم اجراء البحوث على الجينات المماثلة ( تسمى جينات مشتركة التسلسل من الأجداد ) في الكائنات المماثلة. بالإضافة إلى دراسة الأمراض الوراثية وزيادة توافر أساليب التنميط الجيني مما أدى إلى مجال علم الوراثة الدوائي، أي دراسة كيفية التركيب الوراثي على مدى الاستجابة للأدوية.
يختلف الأفراد في ميلهم الموروث للإصابة بالسرطان، والسرطان هو مرض وراثي. و عملية تطور مرض السرطان في الجسم هو مزيج من الأحداث؛ فالطفرات تحدث أحياناً داخل الخلايا في الجسم نظراً لانقسامها، على الرغم من أن هذه الطفرات قد لا تكون موروثة من قبل أي ذرية إلا أنها قد تؤثر على سلوك الخلايا؛ مما يتسبب في نموها في بعض الأحيان وانقسامها بشكل متكرر. هناك آليات بيولوجية تحاول وقف هذه العملية وإعطاء إشارات إلى تقسيم غير لائق في الخلايا التي ينبغي أن تؤدي إلى موت الخلايا، ولكن تحدث أحياناً طفرات إضافية تدفع الخلايا إلى تجاهل هذه الرسائل، وتحدث عملية الانتقاء الطبيعي داخل الجسم وتتراكم الطفرات في النهاية داخل الخلايا لتعزيز النمو الخاص بها، وخلق الورم السرطاني الذي ينمو ويغزو الأنسجة المختلفة للجسم.
تنقسم الخلية عادةً كاستجابة للإشارات فقط تسمى عوامل النمو وتوقف التكاثر عند حدوث اتصال مع الخلايا المحيطة (الاتصال المثبط)، وتنقسم في استجابتها لإشارات النمو المثبطة لعدد محدود من المرات وتموت والتي تبقيها داخل الظهارة والذي لا يُمكنها من الارتحال لغزو أعضاء أخرى. لتتحول إلى خلية سرطانية، يجب أن تتراكم الخلايا أو تجتمع على شكل تحورات أو تغيرات في عدد من الجينات (3-7) التي تسمح لها أن تتجنب كل القواعد التالية: وهي لا تحتاج إلى عامل تكاثر للإنقسام، بل تستمر في التكاثر عندما تتصل بخلايا مجاورة، وتجاهل إشارات التثبيط، وتستمر في التكاثر لأجل غير مسمى ومستمر، وتهرب من الاستماتة وفي النهاية تتمكن من الهرب من الورم الرئيسي، وتعبر بطانة الوعاء الدموي والانتقال عبر مجاري الدم لاستعمار عضو جديد لتكون أورام خبيثة مميتة. وبالرغم من استعداد بعض الجينات على شكل أجزاء صغيرة من السرطانات؛ إلا أن الجزء الأكبر يكون بسبب تكوين طفرات جينية جديدة والتي تظهر عضوياً وتتراكم في خلية واحدة أو عدد قليل من الخلايا التي تنقسم لتكون الورم ولا تنتقل إلى الأولاد ( الطفرات الجسدية). تفقد الطفرات الأكثر شيوعاً أو تمنع مهام بروتين p53 والموروثات الكابتة أوالموقفة للورم أو في مسار بروتين p53 وتكتسب مهمة التطفر في بروتينات راس أو في جينات ورمية أخرى.
طرق البحث
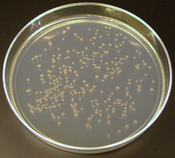
مستعمرات الإشريكية القولونيةالتي تنتج بواسطة الاستنساخ الخلوي
، وكثيراً ما يستخدم منهجية ممثالة في الاستنتساخ الجزيئي.
يمكن التلاعب بالحمض النووي DNA في المختبر. تُستخدم إنزيمات الاقتطاع بشكل شائع كإنزيمات تقطع الحمض النووي DNAفي تسلسلات محددة منتجة قطع متوقعة من الحمض النووي DNA يُمكن تصوير قطع DNA من خلال استخدام الفصل الكهربائي للهلام والذي يفصل القطع حسب طولها. يسمح استخدام أنزيمات الربط بوصل قطع الحمض النووي DNA، وتقويم قطع الحمض النووي مع بعضها من عدة مصادر يستطيع الباحثون إنشاء الحمض النووي DNA المؤشب. يستخدم الحمض النووي المؤشب عادةً بالمشاركة والارتباط مع العضويات المعدلة وراثياً بشكل شائع في حالة البلازميد (القصير الدائري لقطع الحمض النووي مع قليل من الجينات فوقه). بإدخال البلازميدات في البكتيريا وإنماء هذه البكتيريا على صفائح من الآجار (لعزل استنساخ خلايا البكتيريا)، يستطيع الباحثون الإسهاب بسلاسل القطع المدخلة للحمض النووي DNA( تعرف هذه العملية بالتنسيل الجزيئي )، كما يمكن للإستنساخ العودة لإنشاء كائنات حية بوسائل عديدة.) يمكن مضاعفة الحمض النووي DNA أيضاً باستخدام طريقة تسمى تفاعل البوليمراز المتسلسل (ت ب م). باستخدام تسلسل قصير محدد من الحمض النووي، (ت ب م) بإمكانه أن يعزل ويتضاعف إلى عدة أضعاف في المنطقة المستهدفة من الحمض النووي، يمكن أن يُستخدم تفاعل البوليمراز المتسلسل للكشف عن وجود تسلسل محدد من الحمض النووي لخاصية تضاعفه من كميات قليلة جداً.
تسلسل الحمض النووي وعلم الجينوم
تطور واحدة من التقنيات الاساسية لدراسة علم الجينوم ويسمح تسلسل الحمض النووي الباحثون لتحديد التسلسل النيوكليوتيدات في قطع الحمض النووي .وتطور في عام ١٩٧٧ م بواسطة فريدريك سانغر وزملائه في العمل وبصورة روتينية يستخدم التسلسل الاخير قطع الحمض النووي واستطاع الباحثون مع هذه التقنيات الحديثة دراسة الجزيئي وعلاقتهما بكثير من أمراض الإنسان .. قد تسلسل الباحثون مجموعة العوامل الوراثية كثير من الأعضاء لذلك أصبح التسلسل رخيصا بأستخدام أدوات حسابية لخياطتها مع بعض قطع كثيرة الاختلاف (والعملية تسمى الجينوم الجمعية) تستخدم هذه التقنيات لتسلسل الجينوم البشري مما أدى إلى إكمال مشروع الجينوم البشري في عام ٢٠٠٣م تعد التقنيات التسلسل الإنتاجية العالية منخفضة التكلفة بشكل كبير من التسلسل الحمض النووي ويأمل كثير من الباحثين إحضار تكلفة اعادة التسلسل وخفض الجينوم البشري إلى الف دولار أنشأت كمية كبيرة من البيانات التسلسل المتاحة في مجال علم الجينوم والبحث الذي استخدم أدوات حسابية للبحث وتحليل نماذج في الجينوم الكامل في الأعضاء ويعتبر أيضاء علم الجينوم مجال فرعي من المعلومات الحيوية التي تستخدم النهج الحسابي لتحليل مجموعة كبيرة من البيانات البيولوجية.